日前,联盟地区药品集中采购中选结果公布,25个品种有3个为注射剂,5家药企以较低降幅甚至零降幅中选,“躺赢”全国市场。目前已有291个注射剂公布参比制剂,注射剂将是未来一致性评价的“重头戏”。据米内网统计,目前有47个注射剂一致性评价申报(一致性评价补充申请及新注册分类申报上市)企业数超过4家(含4家);8家药企领跑注射剂一致性评价,科伦、扬子江、正大制药、齐鲁申报注射剂品种数均超30个。
扩面集采注射剂过评企业“躺赢”,291个注射剂已有参比制剂
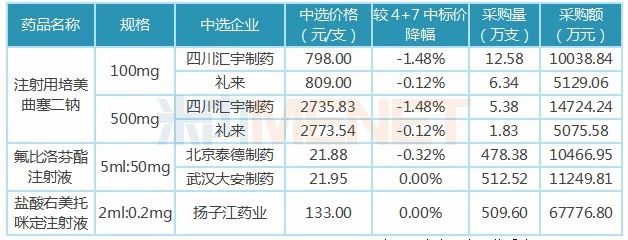
表1:4+7扩面集采中的注射剂
(来源:上海阳光医药采购网)
9月30日,联盟地区
集中采购中选结果公布,25个品种中有3个为注射剂,分别为注射用培美曲塞二钠、氟比洛芬酯注射液、盐酸右美托咪定注射液。因为过评企业少,3个注射剂在此次扩面集采中的中选价同比4+7中标价降幅较低,甚至没有降价。
3个注射剂共5家药企中选,其中3个过评企业都是“光脚”受益者,“躺赢”10亿市场,四川汇宇制药的注射用培美曲塞二钠合计采购额为2.48亿元;武汉大安制药的氟比洛芬酯注射液采购额为1.12亿元;扬子江药业的盐酸右美托咪定注射液采购额为6.78亿元。
在2018年中国公立医疗机构终端竞争格局中,注射用培美曲塞二钠的主导企业为豪森药业(市场份额43.11%),盐酸右美托咪定注射液的主导企业为恒瑞
(市场份额80.3%),因为产品未通过一致性评价,豪森与恒瑞无缘本次扩面集采,未来2个品种的用药格局将变。由此可见,提早布局注射剂一致性评价且有产品过评的
在集采中优势凸显。
9月16日,CDE发布第24批化药仿制药参比制剂目录,共涉及211个药品(以序号计),其中有56个属于注射剂,涉及34个品种(以药品名称计)。34个注射剂中仅3个有企业申报一致性评价,暂未有企业申报的31个注射剂中,不乏一些增长迅速、市场前景良好的品种。
由于过评难度大,目前注射剂一致性评价进展缓慢。截至10月9日,仅12个注射剂有企业通过或视同通过一致性评价。但是,从第21批化学药参比制剂首次出现注射剂的“身影”,至今已有291个注射剂(第21批88个,第22批82个,第23批87个,第24批34个)公布了参比制剂。随着越来越多的参比制剂“浮出水面”,注射剂一致性评价开展进程有望加速。
47个注射剂遭“围攻”,170亿大品种3家药企开抢
据米内网MED中国药品审评数据库2.0,截至10月9日,CDE承办的注射剂一致性评价补充申请受理号有445个,涉及品种123个;CDE承办的按新注册分类(仿制3类、4类及进口5.2类)申报上市的注射剂受理号有481个,涉及品种192个。
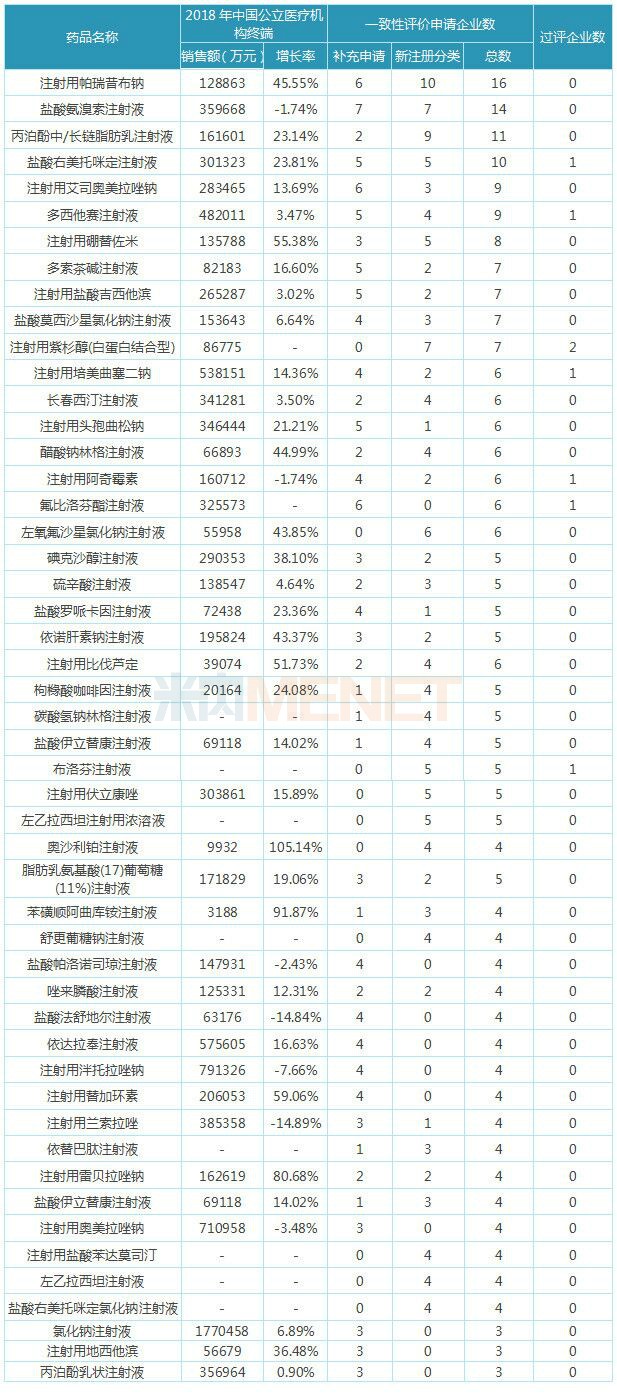
表2:一致性评价申报企业数TOP50注射剂
注:销售额低于3000万用符号-表示
(来源:米内网数据库)
一致性评价申报企业数TOP50注射剂中有47个注射剂申报企业数超过4家(含4家),其中注射用帕瑞昔布钠、盐酸氨溴索注射液、丙泊酚中/长链脂肪乳注射液、盐酸右美托咪定注射液4个品种申报企业数超过10家(含10家)。
50个注射剂中有7个已有企业通过或视同通过一致性评价,盐酸右美托咪定注射液、注射用培美曲塞二钠已被纳入4+7带量
及扩面集采,注射用阿奇霉素、多西他赛注射液等有望纳入4+7扩品种集采,已过评的企业将获得“入场券”,抢夺原研厂家及其他未过评企业的市场。
从销售情况看,50个注射剂中有40个在2018年中国公立医疗机构终端销售额超过1亿元,其中超10亿大品种有29个,氯化钠注射液领跑;从增长趋势看,超过一半的注射剂在2018年的增长率超过2位数,可见用药市场大、有增长潜力的品种,是药企们布局的重点。
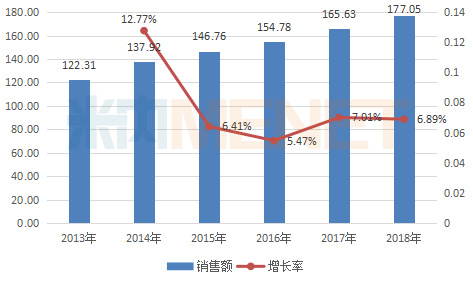
图:2013-2018年中国公立医疗机构终端氯化钠注射液销售情况(单位:亿元)
(来源:米内网中国公立医疗机构终端竞争格局)
据米内网数据,2018年中国公立医疗机构终端化药市场中,氯化钠注射液以1.71%的市场份额位居TOP20产品榜首,近几年来,氯化钠注射液销售额逐年上涨,逐步向200亿市场迈进。目前国内市场有262家药企拥有氯化钠注射液生产批文,石家庄四药、山东齐都药业已提交一致性评价补充申请;山东裕欣药业按仿制4类提交上市申请,谁将首家过评?我们拭目以待!
8家企业领跑注射剂一致性评价,科伦、扬子江、正大制药......
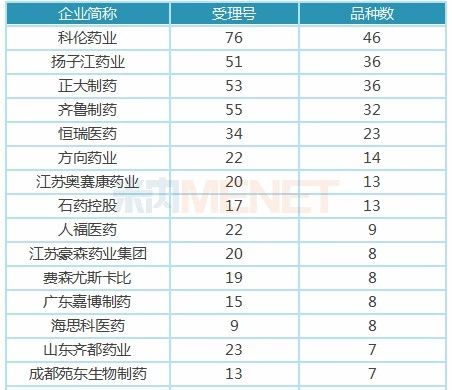
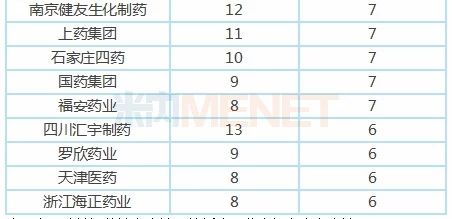
表3:注射剂一致性评价申报品种数超过6个(含6个)的企业
注:含一致性评价补充申请及按新注册分类提交上市申请
(来源:米内网MED中国药品审评数据库2.0)
从目前企业申报注射剂一致性评价情况看,共有24家药企申报6个以上(含6个)的注射剂一致性评价(含一致性评价补充申请及按新注册分类申报上市),其中有8家药企申报品种数超过10个,科伦药业、扬子江药业、正大制药、齐鲁制药申报品种数超过30个。
科伦药业作为大输液龙头企业,在申报注射剂一致性评价方面当仁不让,以76个受理号,46个品种遥遥领先。其中有7个品种首家申报,13个品种独家申报,4个品种暂时未有仿制药获批上市。
扬子江药业也不甘示弱,以51个受理号,36个品种紧接其后,其中有2个品种首家申报,有7个品种独家申报,有6个品种目前未有仿制药获批上市。盐酸右美托咪定注射液已顺利过评,在4+7扩面集采中,扬子江以“光脚企业”身份获得6.7亿的市场。
正大制药有53个受理号,36个注射剂品种获得CDE承办受理,有6个品种首家申报,4个品种独家申报,8个品种目前未有仿制药获批上市。泰德制药的氟比洛芬酯注射液为原研技术转让,在4+7扩面集采中获得1.05亿市场;正大天晴的注射用阿扎胞苷按仿制药3类申报上市,获批生产后视同通过一致性评价。
来源:米内网数据库、CDE官网
注:数据统计截至10月9日,如有疏漏,欢迎指正!

 琼公网安备 46010602000893号
琼公网安备 46010602000893号
